A gripe aviária, também conhecida como Influenza Aviária, é uma doença zoonótica causada pelo vírus Influenza A, com potencial para afetar aves, mamíferos e, em casos esporádicos, humanos. Nos últimos anos, especialmente desde 2022, a Organização Mundial de Saúde Animal (OMSA) tem registrado surtos persistentes de Influenza Aviária de Alta Patogenicidade (IAAP) em diversos países das Américas, incluindo o Brasil.
Embora a transmissão do vírus A(H5N1) para humanos seja considerada rara, os impactos dessa doença são significativos, tanto na saúde pública quanto na economia, devido às altas taxas de mortalidade em aves infectadas e à possibilidade de infecção em humanos expostos a aves ou ambientes contaminados.
Globalmente, casos de gripe aviária em humanos são notificados desde 2003, com uma taxa de letalidade alarmante, atingindo mais de 50% das infecções confirmadas. No Brasil, as primeiras detecções do vírus em aves silvestres ocorreram em 2023, destacando a importância de medidas de biossegurança e monitoramento epidemiológico.
Neste cenário, conhecer o perfil do hemograma em pacientes acometidos pela doença ganha importância para aprimorar o diagnóstico e promover o manejo adequado da doença.
CLASSIFICAÇÃO:
Os vírus da influenza aviária são classificados em dois grandes grupos com base em sua patogenicidade: Influenza Aviária de Baixa Patogenicidade (IABP) e Influenza Aviária de Alta Patogenicidade (IAAP).
Os subtipos de alta patogenicidade (IAAP) são os mais preocupantes, pois causam quadros clínicos graves e disseminados em aves, resultando em altas taxas de mortalidade e sérias consequências econômicas, especialmente na avicultura. Por outro lado, os subtipos de baixa patogenicidade (IABP) apresentam um comportamento mais brando, muitas vezes com sinais clínicos leves ou até mesmo ausência de sintomas visíveis nas aves infectadas.
TRANSMISSÃO DA GRIPE AVIÁRIA:
A disseminação do vírus da influenza aviária ocorre principalmente por aves infectadas, que eliminam o agente por meio da saliva, secreções mucosas e fezes. A transmissão pode ocorrer pelo contato direto com aves acometidas, bem como através da inalação de partículas virais pela exposição a superfícies ou ambientes contaminados, e, raramente, de pessoa para pessoa..
MANIFESTAÇÕES CLÍNICAS EM HUMANOS:
As manifestações clínicas da infecção por influenza aviária em humanos podem variar amplamente, desde quadros respiratórios leves até complicações graves e potencialmente fatais e costumam surgir entre dois e oito dias após contato com o vírus.
Os sintomas mais comuns incluem febre alta (≥38°C) e tosse, frequentemente seguidos por dispneia ou desconforto respiratório. Em diversos casos, também são relatados sintomas gastrointestinais, como náusea, vômito e diarreia.
Em alguns casos há a presença de sintomas como dor de garganta, coriza, dor abdominal, sangramento nasal ou gengival, dor no peito e encefalite. Esses sinais demonstram a capacidade do vírus de causar uma doença sistêmica, afetando múltiplos órgãos.
As complicações mais graves incluem pneumonia severa, insuficiência respiratória, falência de múltiplos órgãos, choque séptico e o desenvolvimento de infecções secundárias bacterianas ou fúngicas.
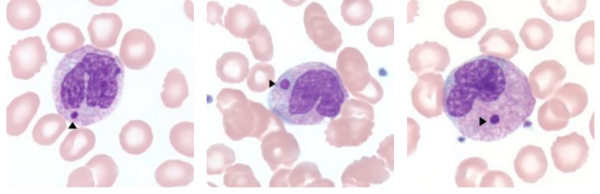
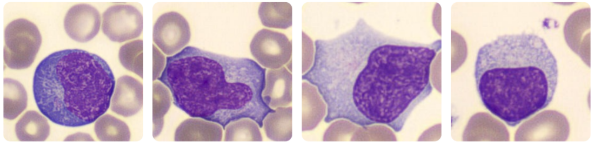
HEMOGRAMA NA GRIPE AVIÁRIA:
Os achados laboratoriais mais comuns são:
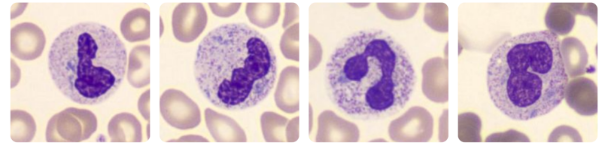
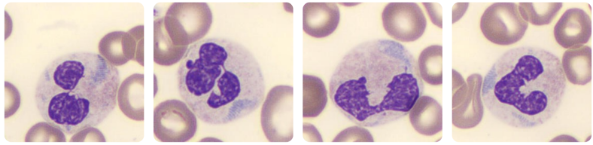
- Leucopenia ou linfopenia
- Trombocitopenia
- Anemia
- Coagulação intravascular disseminada (CIVD)
- Neutrofilia com ou sem desvio à esquerda pode indicar infecção secundária bacteriana.
O próximo passo de todo analista que deseja ter mais segurança na bancada
Todo analista que busca se destacar e se tornar um profissional mais atualizado, capacitado e qualificado para o mercado de trabalho precisa considerar uma pós-graduação. Isso porque, um profissional com especialização é valorizado na área laboratorial; esse é um fato inegável.
Por isso, unimos o útil ao agradável ao desenvolver uma pós-graduação em Hematologia Laboratorial e Clínica para aqueles que procuram a comodidade de uma pós-graduação 100% online e ao vivo, sem abrir mão da excelência no ensino.
Além disso, contamos com um corpo docente altamente qualificado, composto pelos melhores professores do Brasil, referências em suas áreas de atuação. Nossa metodologia, que combina teoria e prática da rotina laboratorial, garante um aprendizado efetivo e de qualidade.
No Instituto Nacional de Medicina Laboratorial, temos apenas um objetivo: mais do que ensinar, vamos tornar VOCÊ uma referência.
Toque no botão abaixo e conheça a pós-graduação em Hematologia Laboratorial e Clínica.
Referências:
DE MELO, Andréa Maria Carneiro et al. Doença infecciosas das aves: revisão de literatura. Brazilian Journal of Animal and Environmental Research, v. 1, n. 2, p. 310-314, 2018.
GRIGOLLO, Eduardo Bianchi et al. INFLUENZA AVIÁRIA. Anais da Feira de Ciência, Tecnologia, Arte e Cultura do Instituto Federal Catarinense do Campus Concórdia, v. 6, n. 1, p. 39-39, 2023.
MORAES, H. L. S.; SALLE, CARLOS TADEU PIPPI; CARON, LUIZ FELIPE. Influenza aviária. Doenças de Aves. Berchieri Jr A, Macari M. Ed Facta, 2000.
MARTINS, Nelson Rodrigo da Silva et al. Influenza Aviária. Cad. téc. vet. zootec, p. 09-32, 2015.
MACHADO, Luanna Cristina Alves; CASTRO, Izabela Cruvinel Di; PARENTE, Leila Maria Leal. INFLUENZA AVIÁRIA A-H5N1: revisão de literatura. REVISTA DE TRABALHOS ACADÊMICOS-UNIVERSO–GOIÂNIA, v. 1, n. 8, 2023.