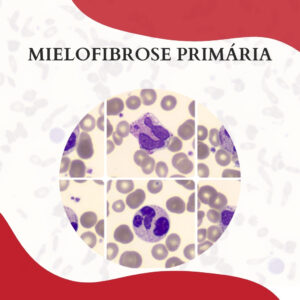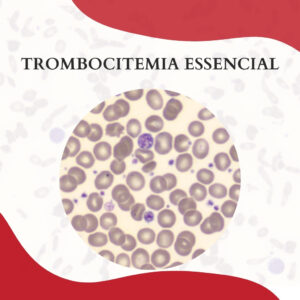
TROMBOCITEMIA ESSENCIAL
Leitura: 3 min
A trombocitemia essencial (TE) é uma neoplasia mieloproliferativa crônica caracterizada por uma produção excessiva de plaquetas pelo sistema hematopoiético. Essa neoplasia é mais prevalente em idosos e no sexo feminino, apresentando como características clínicas a esplenomegalia e o risco de trombose ou hemorragia devido à disfunção plaquetária associada à doença. […]