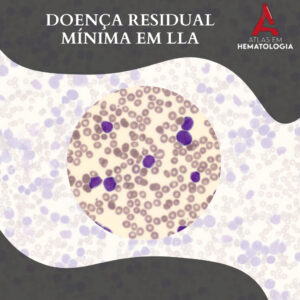
DOENÇA RESIDUAL MÍNIMA EM LLA
Leitura: 4 min
A Leucemia Linfoblástica Aguda é um tipo de leucemia caracterizada pela proliferação anormal de linfoblastos na medula óssea, sangue periférico e outros tecidos. Embora os avanços terapêuticos tenham aumentado significativamente as taxas de remissão completa em pacientes com LLA, a presença de células leucêmicas residuais, conhecidas como Doença Residual Mínima […]